



Estudio comparativo mediante una colorimetría entre la concentración teórica de almidón que aparece en el etiquetado de ciertas bebidas y la que realmente contienen
Andrea de Andrés Murillo
Resumen
A menudo presenciamos anuncios que nos inducen a pensar que determinados productos tienen una composición concreta, pero muchas veces resulta una idea falsa con la que se pretende vender el producto, esto es la publicidad engañosa. En este trabajo analizaré este aspecto de la publicidad desde un punto de vista biológico, limitándome a las biomoléculas que componen un determinado producto. En concreto me basaré en las bebidas refrescantes y en la biomolécula del almidón, que en la etiqueta de las bebidas aparece como hidratos de carbono. La idea general que la sociedad ha adquirido de los glúcidos en la publicidad es negativa, por lo que asocian la reducción de estos con que el producto será más sano y engordará menos.
Tomaré una muestra de 16 bebidas, y mediante el uso del colorímetro y el tratamiento estadístico de los datos determinaré la concentración de almidón de estas y posteriormente comprobaré si coincide con lo expuesto en el etiquetado. Además también me fijaré en la diferencia que existe entre la concentración que he obtenido y la de la etiqueta en marcas blancas como Hacendado y en marcas más populares y conocidas como Coca-cola.
Tras realizar las pruebas, se pudo observar que los resultados obtenidos concuerdan con la hipótesis que se planteó, ya que las concentraciones que se han alcanzado en la práctica son mayores de las que aparecen en las etiquetas de las bebidas analizadas. Además, se observa que la diferencia entre la concentración de la etiqueta y la obtenida en la práctica es bastante más pequeña en marcas blancas que en las marcas más comerciales.
1. Introducción
1.1 Conceptos básicos
Mediante un colorímetro, calcularé la concentración de almidón en varias bebidas, como explico en el apartado siguiente. Para ello, se trabaja con la transmitancia y la absorbencia y es preciso conocer estos conceptos.
La transmitancia es una magnitud que expresa la cantidad de energía en forma de luz que atraviesa a una muestra por unidad de tiempo1. Se mide en J/s=W (potencia).
La absorbencia es una magnitud que expresa la cantidad de energía en forma de luz que retiene o absorbe una muestra por unidad de tiempo. También se mide en J/s o W.
Por lo tanto cuanta más luz absorba una sustancia menos se transmitirá al otro lado cuando la atraviese, es decir, estas dos variables son inversamente proporcionales.
1.2 Uso del colorímetro
Cada sustancia química absorbe una determinada frecuencia de luz. Parece obvio que cuanta más concentración de dicha sustancia haya más luz absorberá, es decir, las variables concentración y absorción son proporcionales, o lo que es lo mismo, concentración y transmisión son inversamente proporcionales. Por eso el colorímetro es un instrumento que sirve para medir tanto la absorción como la transmisión a partir de la cual se puede calcular la concentración de un soluto. Consta de unos sensores que comparan la cantidad de luz que entra en la mezcla con la que sale2. Su uso es muy sencillo, lo primero que hay que hacer es calibrarlo introduciendo una cubeta con agua destilada y a continuación coger una muestra de concentración conocida del mismo soluto que se va a estudiar. La cubeta tiene dos laterales opuestos irregulares (rayados) y otros dos lisos, es importante que los lados completamente lisos sean los que se sitúen en la dirección de la luz, para que esta pase a través sin ninguna oposición. El modelo de colorímetro que voy a emplear es el CH1003-001, y contiene cuatro tipos de luz diferente: azul, verde, amarillo y rojo. Con la muestra conocida se calcula la absorbencia y la transmitancia con cada luz y se elegirá la más adecuada que maximice la precisión de la lectura para la sustancia que se trabaje. Esta será la que dé como resultado la absorbencia más alta y la transmitancia más baja, que es un color opuesto al color de la muestra, nunca el mismo3.
A partir de los datos obtenidos con las concentraciones conocidas, se dibuja una gráfica de estas frente a la absorbencia de la cual se puede extraer la concentración de las demás muestras haciendo una extrapolación. Pero para que sea más exacto, se puede emplear la ley de Beer-Lambert conociendo algunas incógnitas.
1.3 Ley de Beer-Lambert
En óptica, la ley de Beer-Lambert relaciona la absorbencia de la luz con las propiedades del material atravesado, es decir, la concentración (c), la longitud de la cubeta que le contiene (l) y el coeficiente de absorción molar (α).

La ley se puede expresar de varias maneras diferentes.
La transmitancia4 T, que en el colorímetro viene dada en porcentaje, se puede expresar como:%T= ·100
Esta se relaciona con la absorbencia A como
A=log =2-log%T
Y relacionando ambas variables con las propiedades de la muestra, la ley dice que:
A=αcl => =10-αcl
Pudiendo conocer fácilmente datos como A, l, c y ᾳ (con las concentraciones conocidas) podemos prescindir del uso de otras variables como la intensidad o la longitud de onda, simplificando la obtención de datos. A partir de estas fórmulas, se pueden obtener algunas afirmaciones que pueden ser útiles a lo largo de la práctica. Si no se transmite nada (T=0) la absorbencia será máxima, mientras que si se transmite el 100%, la absorbencia será nula5.
| % Transmitancia | Absorbencia | |
|---|---|---|
| 0 | 0 | 2,3 |
| 1 | 0,01 | 2 |
| 10 | 0,1 | 1 |
| 100 | 1 | 0 |
Siguiendo esta ley y manteniendo l constante, se deduce que la escala logarítmica de la absorción está linealmente relacionada con la concentración. Es decir, un grafico de A en función de c da una línea recta que pasa por el origen (ya que cuando A=0 significa que la concentración también es nula), según la siguiente imagen:
Esta gráfica no es un método muy exacto pero se puede emplear junto a la ley de Beer-Lambert para aproximar y confirmar los resultados, ya que con las dos concentraciones conocidas de almidón y la absorbencia obtenida en el colorímetro tenemos dos puntos de esta y se puede trazar la recta.
1.4 El almidón
Todos estos datos los aplicaré a una biomolécula concreta, el almidón, presente en varias bebidas que analizaré. Es un glúcido que aparece continuamente tanto en la dieta humana como en la de la mayoría de los animales que se alimentan de vegetales, ya que es un polisacárido de origen vegetal (sintetizado naturalmente por las plantas). Se llaman comúnmente hidratos de carbono porque a partir de él podemos obtener todos los carbohidratos derivados más simples. Su estructura comparte algunas características con la celulosa debido a que ambos son de origen vegetal, pero la función del almidón es energética mientras que la de la celulosa es estructural. La estructura molecular del almidón corresponde a dos tipos de moléculas7:
- Amilosa. Es un polímero de glucosas, (alfa-D-glucopiranosa) unidas mediante enlaces de tipo 1-->4. Tiene una estructura helicoidal compuesta por 6 moléculas de glucosa en cada vuelta y al disolverse en agua da lugar a dispersiones coloidales. Al hidrolizarse por la acción de la amilasa se descompone en otro polisacárido menor, la dextrina, y luego en maltosa para dar finalmente glucosa. La amilosa constituye aproximadamente el 30% de la molécula del almidón8.
- Amilopectina. Es también un polímero de la glucosa, pero en este caso la estructura molecular es ramificada ya que aparte de los enlaces 1,4, cada unos 12 restos de glucosa aproximadamente se forma un enlace 1,6 que provoca una estructura helicoidal con numerosas ramificaciones. Es menos soluble en agua que la amilosa y la amilasa no puede atacar los enlaces 1,6 y tienen que ser rotos con otras enzimas llamadas R-desramificantes (amilopectina 1-->6-glucosidasa).
Cuando se tratan sustancias que llevan almidón con el lugol (yodo), un reactivo que reconoce específicamente el almidón, este pasa de su color característico rojizo a un azul-morado intenso. Este hecho se debe a la estructura helicoidal del almidón, ya que los átomos de yodo se introducen y quedan “atrapados” en las espirales9. Esto ha sido útil a la hora de realizar la práctica ya que la sustancia tiene que tener una coloración, a la hora de elegir la luz adecuada, puesto que en lo blanco o transparente la absorbencia es nula.
El coeficiente de absorción molar cambia según la longitud de onda, el pH, el disolvente empleado y la naturaleza del compuesto absorbente, pero como todas estas variables son iguales a lo largo de toda la práctica, podemos considerar que es constante.
1.5 Tratamiento de los azúcares en la publicidad
Todos los glúcidos, comúnmente llamados azúcares, suelen tener una mala reputación en la publicidad. Generalmente se asocian a la idea de que engordan y de que no son saludables, por lo que siempre se tiende a comprar productos ligths o bajos en hidratos de carbono. Estos productos incluso hacen pensar que simplemente por el hecho de tomarlos se adelgaza. Pero el ser light simplemente significa que contienen un 30% menos de calorías que un producto que ya está en el mercado10, por lo que no adelgaza. Por tanto al ingerir dos productos lights ya se está tomando mayor calidad de calorías que consumiendo sólo una pieza del producto normal.
1.6 Justificación de la elección del tema
Una de mis partes favoritas del programa BI son las prácticas de laboratorio, en especial las de biología, por lo que este factor contribuyó a mi decisión de realizar la monografía sobre la asignatura de biología. Además, la parte de esta asignatura que más me ha llamado siempre la atención a la hora de trabajar en el laboratorio es la bioquímica. Esto, unido a unos trabajos sobre las biomoléculas en la publicidad y las inconcurrencias de esta que habíamos hecho previamente me llevó a elegir este tema. Es muy interesante poder comprobar por medios propios si la composición de bebidas que se consumen a diario es realmente la que se vende. Pese a las dificultades que este trabajo conlleva, como aprender a manejar el colorímetro, considero que, a parte de mis preferencias, este trabajo es de gran importancia por la intención de demostrar que a menudo somos engañados por la publicidad.
1.7 Planteamiento del problema
¿Es correcta la concentración de hidratos de carbono, almidón, que aparece en el etiquetado de determinadas bebidas de carácter refrescante?
1.8 Hipótesis
Casi con toda seguridad, los resultados que obtenga no concuerden con lo que aparece en la etiqueta de las bebidas, que es lo que teóricamente debería resultar, y puede ser debido principalmente a dos razones. Una es por los errores cometidos durante el proceso, como la contaminación de la muestra o el mal uso de los aparatos de medida (esto se analizará al final en un apartado de evaluación) y pero también es muy probable que se pueda deber a que la concentración con la que ha sido etiquetada una bebida no era la real. En este caso, lo lógico es que la cantidad real de almidón y de azúcares sea superior a la que se vende, ya que la idea que tiene la sociedad del azúcar y los hidratos de carbono es que no son buenos en grandes cantidades. Por ello se intenta vender como que tiene menos azúcares, en este caso almidón, de la que realmente lleva.
1.9 Variables
- Variables independientes: Absorbencia y transmitancia
- Variable dependiente: concentración de almidón.
- Variables controladas: cantidad de muestra que se emplea y cantidad de lugol.
1.10 Método de control de variables
La absorbencia y la transmitancia quedan controladas mediante el colorímetro, que nos proporciona directamente este dato tras introducir la muestra. La transmitancia, dada en tanto por ciento, tiene un error de ±1 y la absorbencia, dada con dos cifras decimales en un rango de 0 a 2.3 tendrá un error de ±0.01.
La cantidad de sustancia que se introduzca en las cubetas, que será siempre 3ml, será controlada mediante una pipeta milimetrada, cuyo error es ±0.02. La cantidad de lugol también será constante, se echarán 3 gotas con un cuentagotas. La concentración de almidón se obtiene a partir de la absorbencia y la transmitancia y las distintas fórmulas expuestas anteriormente. Sus errores quedan determinados por estas variables.
2. Procedimiento
Tras tener todo el material listo y conocer el uso del colorímetro, lo primero que hay que hacer es calibrarlo. Para ello se usa agua destilada, completamente transparente por lo que toda la luz se transmite y no se absorbe nada. Se introduce la cubeta en el colorímetro y se tapa con un tubo negro para que no influya la luz exterior. Con una de las cuatro luces seleccionada, se presiona el botón CAL, entonces mostrará T=100 o A=0 y estará calibrado.
A continuación se necesitan dos muestras de concentración conocida. Crearé a partir de agua y almidón en polvo dos disoluciones de concentraciones diferentes, de 5% y 10%. Pero no vale con estas muestras, ya que el color tiene que ser constante en todo lo que midamos, por lo que usaremos el lugol. Todas las disoluciones que analizaré, tanto las bebidas como las dos de concentración conocida, se supone que tienen almidón por lo que usaremos este colorante que torna en color azul oscuro-morado al reconocer el almidón para que todas tengan el mismo color más o menos. A partir de la intensidad de este se va a medir la concentración de cada muestra, por lo que se debe agregar a todas las muestras siempre la misma cantidad de lugol con la misma concentración.
Para fabricar las dos disoluciones de almidón necesarias, introduciré 100ml de agua en dos probetas y echaré 5 y 10 gramos de almidón con lo que quedarán dos muestras de concentraciones 5% y 10%. A continuación hay que añadir lugol que, como ya he dicho tiene que ser siempre la misma por lo que mezclaremos siempre 3ml de la disolución y 3 gotas de lugol al 0,4%. Después se procede a introducir estas dos muestras en el colorímetro con la luz con que ha sido calibrado. Se calcula la absorbencia y transmitancia con cada una y se repite el procedimiento con el resto de luces, calibrando siempre de cambiar el color seleccionado. Una vez realizado el proceso, se selecciona la luz apropiada como ya se ha explicado. A continuación, ya sólo usando la luz resultante, se introducen en las cubetas 3ml del resto de bebidas junto con el lugol hasta obtener la transmitancia y absorbencia de todas las bebidas.
Una vez que se tengan los datos prácticos, se calculará la concentración a partir de la ley de Beer-Lambert y de una gráfica en las que se representará A en función de la concentración, puesto que ya tenemos dos puntos conocidos de esta.
Por último, se compararán las concentraciones obtenidas experimentalmente con las que teóricamente debería tener cada bebida según la etiqueta. Para conocer esta concentración teórica, nos fijaremos en la parte de “información nutricional” donde pone “Hidratos de carbono: X, de los cuales azúcares: Y”, el dato que debemos emplear será Y, aunque muchas veces coincide con la cantidad total de hidratos de carbono presentes en la bebida.
3. Material
- Agua destilada
- Pipeta milimetrada
- Colorímetro
- Balanza de laboratorio
- Tubos de ensayo
- Cubetas
- Almidón en polvo
- Agua
Bebidas:
- Fanta naranja
- Coca-cola
- Coca-cola zero
- Coca-cola light
- Schweppes de limón
- Zumo Don Simón Mediterráneo
- Trina de naranja
- Sprite
- Casera
- Aquarius naranja
- Zumo naranja Hacendado
- Naranja Hacendado
- Licor de manzana Hacendado
- Limón Hacendado
- Bebida isotónica de naranja Hacendado
- Zumo de naranja alipende
4. Obtención y procesamiento de datos
4.1 Obtención de datos brutos
La primera recogida de datos tiene lugar a la hora de elegir la luz adecuada con la sustancia que vamos a medir, la que provoque el mínimo error como ya he explicado. Los datos que se obtuvieron con las dos muestras de almidón de concentración conocida con cada luz son:
| Muestra 1. C=10% | Muestra 2. C=5% | |||
|---|---|---|---|---|
| Transmitancia (±1.00 W) |
Absorbencia (±0.01W) |
Transmitancia (±1.00 W) |
Absorbencia (±0.01W) |
|
| Azul | 13.00 | 0.89 | 35.00 | 0.45 |
| Verde | 23.00 | 0.64 | 47.00 | 0.32 |
| Amarillo | 30.00 | 0.52 | 55.00 | 0.26 |
| Rojo | 35.00 | 0.46 | 59.00 | 0.23 |
Se observa que la luz más adecuada es la azul, ya que tiene la transmitancia más baja y la absorbencia más alta lo que nos garantiza un mínimo error. Además aumenta la fiabilidad del resultado la coincidencia de las dos muestras, en los dos casos la diferencia con respecto a las otras es muy grande. Este resultado era de esperar ya que como he dicho antes la luz es la opuesta a la del color de la muestra, que en este caso es roja. Se puede observar en consecuencia como la transmitancia más alta es en la luz roja que es la menos adecuada. Con los datos de la luz azul, ya tenemos dos puntos de la gráfica que se representará más adelante.
| Bebidas | Absorbencia
(±0.01W) |
Transmitancia
(±1W) |
Concentración de la etiqueta % (g/ml)1 |
|---|---|---|---|
| Almidón 1 | 0.89 | 13 | 10.00 |
| Almidón 2 | 0.45 | 35 | 5.00 |
| Fanta naranja | 1.21 | 6 | 12.90 |
| Coca-cola | 1.03 | 9 | 10.60 |
| Zumo naranja Hacendado | 0.86 | 14 | 9.20 |
| Coca-cola Zero | 0.03 | 93 | 0.00 |
| Coca-cola Light | 0.04 | 91 | 0.00 |
| Schweppes de limón | 0.69 | 20 | 7.20 |
| Licor de manzana Hacendado | 0.15 | 71 | 1.40 |
| Zumo Don Simón Mediterráneo | 1.15 | 7 | 12.30 |
| Trina de naranja | 0.96 | 11 | 9.90 |
| Sprite | 1.06 | 9 | 10.70 |
| Naranja Hacendado | 0.70 | 19 | 7.50 |
| Limón Hacendado | 0.68 | 21 | 7.50 |
| Bebida isotónica de naranja Hacendado | 0.49 | 32 | 5.30 |
| Casera | 0.01 | 98 | 0.00 |
| Zumo de naranja Alipende | 0.92 | 12 | 10.00 |
| Aquarius naranja | 0.77 | 17 | 7.90 |
4.2 Obtención de datos procesados
A partir de las dos concentraciones conocidas de almidón, podemos calcular el coeficiente de absorción de este, α, que se mantendrá constante en todas las muestras. Para ello necesitamos conocer la absorbencia que ya hemos calculado con el colorímetro respectivamente para ambas muestras, la concentración que ya la sabíamos y la longitud de la cubeta, 1cm=0.01m:
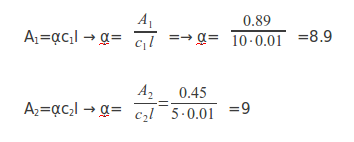
Como se ve, el resultado es más fiable dado que obtenemos prácticamente el mismo para las dos concentraciones distintas. La pequeña diferencia probablemente se debe al error del colorímetro en cuanto a la absorbencia (±0.01) por lo que se tomará que el coeficiente de absorbencia es una media de los dos: ᾳ=8.95. A continuación se calculará la concentración de todas las bebidas en la ecuación anterior ya que conocemos ᾳ y sólo quedará como incógnita c:
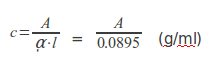
| Bebidas | Concentración prácticac (g/ml) ±0.01 g/ml |
Concentración de la etiqueta% (g/ml) | Diferencia entre las dos concentraciones (g/ml)
±0.01 g/ml |
|---|---|---|---|
| Fanta naranja | 13.52 | 12.90 | 0.62 |
| Coca-cola | 11.51 | 10.60 | 0.91 |
| Zumo naranja Hacendado | 9.61 | 9.20 | 0.41 |
| Coca-cola Zero | 0.34 | 0.00 | 0.34 |
| Coca-cola Light | 0.45 | 0.00 | 0.45 |
| Schweppes de limón | 7.71 | 7.20 | 0.51 |
| Licor de manzana Hacendado | 1.68 | 1.40 | 0.28 |
| Zumo Don Simón Mediterráneo | 12.85 | 12.30 | 0.55 |
| Trina de naranja | 10.73 | 9.90 | 0.83 |
| Sprite | 11.84 | 10.70 | 1.14 |
| Naranja Hacendado | 7.82 | 7.50 | 0.32 |
| Limón Hacendado | 7.60 | 7.50 | 0.10 |
| Bebida isotónica de naranja Hacendado | 5.47 | 5.30 | 0.17 |
| Casera | 0.11 | 0.00 | 0.11 |
| Zumo de naranja Alipende | 10.28 | 10.00 | 0.28 |
| Aquarius naranja | 8.60 | 7.90 | 0.70 |
| Media | 7.50 | 7.03 | 0.47 |
4.3 Presentación de datos procesados
Según se dijo en la introducción, con los datos de la absorción de las dos concentraciones conocidas de almidón se puede representar una gráfica ya que estas dos variables siguen una distribución lineal.
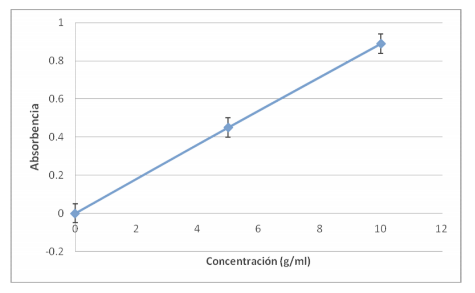
Al introducir en este gráfico las concentraciones prácticas obtenidas, deberían estar alineados junto con las concentraciones conocidas de almidón, y como se comprueba en este gráfico así es:
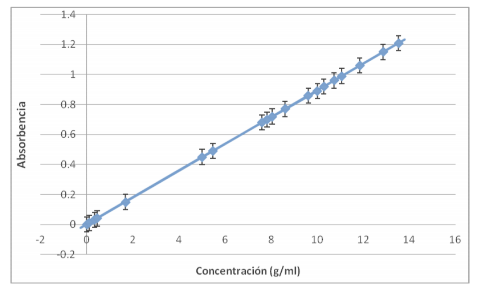
5. Análisis de datos
A partir de los datos obtenidos se puede observar que todas las concentraciones son distintas de las de las etiquetas, pero no sólo eso ya que era de esperar que no se obtuviera exactamente la misma, sino que es siempre superior a la que teóricamente debería ser. Como mínimo, la diferencia es de un 0,10 % en el caso del limón de la marca Hacendado. Cabe esperar que la diferencia de la naranja Hacendado, ya que tiene la misma concentración en su etiqueta y es de la misma marca, fuera la misma que la del limón. Pero en cambio vemos que la diferencia es de un 0,32% respecto al etiquetado y un 0,22% más que el limón. Es una distancia amplia pero al fijarnos en la absorbencia de cada uno vemos que no son tan diferentes (0,70 y 0,68) por lo que puede que realmente sí que tengan la misma concentración y que la diferencia se deba a errores del colorímetro o a la hora de preparar las muestras para analizar. Pero en general se puede concluir que las bebidas de la marca Hacendado son las que menor diferencia presentan respecto a la concentración de hidratos de carbono que aparece en su etiqueta, estando todas en un intervalo entre un 0.10 y 0.32% de diferencia respecto a la concentración de la etiqueta. Además, la variación de concentración en el caso del zumo de marca Alipende, otra muy nueva y poco conocida, es también bastante pequeña, un 0.28%.
Pero por el contrario, las marcas más conocidas y populares son las que, según mi práctica, tienen una mayor concentración de almidón de la que debería ser teóricamente. Concretamente la coca-cola presenta una concentración de 11.51 mientras que en su etiqueta aparece 10.6, lo que significa una diferencia significativa. Además, respecto a esta marca, cabe destacar también que al analizar sus bebidas light y zero, supuestamente sin hidratos de carbono ni azúcares, se ha obtenido que realmente sí que contienen al menos almidón, con un porcentaje de 0.45 y 0.34 respectivamente.
También la casera, supuestamente agua con gas por lo que debería tener un porcentaje nulo de azúcares, vemos que presenta una concentración mínima de un 0,11. Es tan mínima que al echar el lugol a la muestra este permaneció de color rojo, pero sería conveniente que los productores se aseguraran de que la concentración es nula. Desde un punto de vista global, fijándonos en la media de una variación del 0,47% entre la concentración teórica y la práctica, se puede concluir que la diferencia no es muy amplia puesto que sólo consumimos aproximadamente medio gramo más por cada 100ml de lo que pensamos, pero debería ser nula.
Podemos cerciorarnos de que los datos obtenidos mediante la ley de Beer-Lambert son fiables ya que concuerdan con la gráfica realizada a partir de las dos concentraciones conocidas de almidón, y todos se alinean según una distribución lineal que pasa por el origen. También se puede comprobar que el uso del colorímetro ha sido correcto ya que la relación entre la absorbencia y la transmitancia se cumple, por ejemplo con la bebida isotónica de Hacendado:
A=2-logT%
A=2-log32=0.49
6. Conclusión
Tras el análisis de la absorbencia y la transmitancia que presentan las 16 bebidas analizadas en el colorímetro y obtener sus respectivas concentraciones, se puede concluir que la hipótesis planteada al principio se cumple, puesto que la concentración de almidón en las bebidas con las que se ha trabajado es mayor a la que presenta en su etiqueta. Además, también se ha sacado en claro que las marcas blancas, concretamente Hacendado que es la marca blanca en la que he basado mi estudio, la diferencia de concentraciones es mínima mientras que en las más conocidas y tradicionales como pueden ser Coca-cola, Fanta o Aquarius, la diferencia es significativamente mayor, llegando a rozar un 1% más de concentración respecto a la teórica.
Esta monografía ha permitido poner de manifiesto la importancia de las biomoléculas en la publicidad, ya que la sociedad se basa en la concentración de estas para elegir que productos comprar, por lo que muchas veces no contienen realmente lo que pensamos. En este caso la concentración real de azúcares es mayor que la del etiquetado por lo que debemos incidir en que la veracidad de los datos de la etiqueta debe ser determinada antes de comprar.
Además, todo esto podría desembocar en nuevos aspectos para trabajar de cara a futuras investigaciones sobre las biomoléculas en la publicidad, ya que habiendo comprobado que la concentración de hidratos de carbono real no es la de la etiqueta, el resto de datos también podrían ser incorrectos.
7. Evaluación y propuestas de mejora
El principal problema que se ha podido encontrar y que ha podido afectar al desarrollo de la práctica es la contaminación. Primeramente el agua destilada que usamos para calibrar el colorímetro puede que estuviera contaminada y como consecuencia se calibrara mal y todos los resultados de absorbencia y transmitancia hubieran variado en alguna cifra. Para solucionar esto deberíamos usar un bote de agua destilada recién abierto ya que el que usé era del laboratorio y había sido utilizado previamente.
Además tenemos el mismo problema con las bebidas empleadas, ya que son demasiadas e involuntariamente puede haberse utilizado una pipeta usada previamente con una nueva bebida lo que provocaría la contaminación de esta y como consecuencia su concentración calculada no sería correcta. Para impedir esto es preciso que se usen materiales diferentes para cada muestra y que una vez usados para una bebida, tanto las pipetas como las cubetas se laven adecuadamente.
Por último, se podría poner en duda la fiabilidad de los datos ya que se ha trabajado únicamente con 16 muestras pero el hecho de que la concentración hallada en todas supere la de la etiqueta y en ningún caso sea igual o inferior les da una alta fiabilidad. Para hacer un estudio más amplio y detallado se podría emplear un mayor número de muestras y más variabilidad de marcas blancas para comprobar que en todas se cumplen las afirmaciones establecidas.
8. Bibliografía
- La Enciclopedia, EL PAIS. Salvat Editores S.A., 2003.
- SOGORB, Miguel Ángel. Técnicas analíticas de contaminantes químicos. Ediciones Díaz de Santos S.A., 2004.
- HARRIS, Daniel C. Análisis químico cuantitativo. Editorial Reverté S.A., 2007.
- FORNAGUERA, Jaime y GÓMEZ, Georgiana. Bioquímica: la ciencia de la vida, EUNED.
- SEYMOUR, Raimond B. Introducción a la química de los polímeros. Editorial Reverté S.A., 1995.
9. Webgrafía
- http://www.bioquimica.dogsleep.net/Laboratorio/Plummer/Chp04.pdf
- http://www.quantik.com.co/Home/Espanol/Productos/Colorimetro/colorimetro.html
- http://www.profes.net/rep_documentos/Propuestas_2%C2%BA_ciclo_ESO/BA%20Glucidos.%20identificaci%C3%B3n_del_almid%C3%B3n.pdf
- http://www.slideboom.com/presentations/118821
1. La Enciclopedia, EL PAIS. Salvat Editores S.A., 2003. Tomo 19 página 15093. ↑
2. http://www.quantik.com.co/Home/Espanol/Productos/Colorimetro/colorimetro.html↑
3. SOGORB, Miguel Ángel. Técnicas analíticas de contaminantes químicos. Ediciones Díaz de Santos S.A., 2004. Págs 85-87. ↑
4. Nótese que el término transmisión se refiere al proceso físico de la luz atravesando una muestra, mientras que la transmitancia se refiere a una cantidad matemática, que es la que obtenemos con el colorímetro. Lo mismo sucede con la absorción y la absorbencia. ↑
5. HARRIS, Daniel C. Análisis químico cuantitativo. Editorial Reverté S.A., 2007. Pág 411.↑
6. http://www.bioquimica.dogsleep.net/Laboratorio/Plummer/Chp04.pdf.↑
7. FORNAGUERA, Jaime y GÓMEZ, Georgiana. Bioquímica: la ciencia de la vida, EUNED. Páginas 170-171.↑
8. SEYMOUR, Raimond B. Introducción a la química de los polímeros. Editorial Reverté S.A., 1995. Página 191. ↑
9. http://www.profes.net/rep_documentos/Propuestas_2%C2%BA_ciclo_ESO/BA%20Glucidos.%20identificaci%C3%B3n_del_almid%C3%B3n.pdf.↑
10. http://www.slideboom.com/presentations/118821.↑
11. La concentración de la etiqueta no tiene error dado que se considerará que es exacta.↑